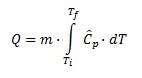Primeros pasos
Cuándo se detectan en la naturaleza sustancias o compuestos de alto valor añadido de una determinada complejidad estructural y, que podrían satisfacer una necesidad en el mercado, tanto presente como futura, habitualmente se plantea la duda entre si resulta más rentable el obtener estas sustancias por síntesis química u obtenerla mediante el cultivo / cría del organismo que la produce, ya sea de origen animal o vegetal.
Existen bases de datos donde se puede consultar si este compuesto ya sido catalogado, sus propiedades físico-químicas, procedencia, cinética, farmacología u otras propiedades que podrían ser de interés para el objetivo del proyecto.
Habitualmente, los compuestos tipo inorgánico tienen estructuras relativamente simples y que se pueden obtener mediante rutas de síntesis químicas de unos pocos pasos.
Por otro lado, la gran mayoría de compuestos presentes en la naturaleza de tipo orgánico, ya bien sea como constituyente de un organismo o como parte de su metabolismo (metabolito), suelen ser moléculas de alta complejidad estructural que requieren de vías de síntesis con un gran número de pasos y requerimientos muy elevados en cuanto a la pureza de los reactivos, lo que encarece el proceso y lo torna menos viable desde un punto de vista económico; con el añadido de los gastos y daños colaterales sobre el medio ambiente.
Un ejemplo de la situación anteriormente descrita, en cuanto a necesidades de mercado a cubrir, sería el de la ingente cantidad de tensioactivos que se prevé será necesario obtener, ya bien sea mediante procesos químicos o bioquímicos, para hacer frente a la demanda creciente en sectores tales como el de la higiene alimentaria,el farmacéutico, el de tratamiento de efluentes residuales, etc. fruto del aumento de la población mundial y del, en ocasiones exponencial ritmo de consumo del mercado, pero que a la vez deberán mostrar propiedades mejores que las actuales, fundamentalmente respecto a su estabilidad medioambiental, siendo los valores actualmente existentes, demasiado elevados para que un aumento en su uso, no provoqué problemas de toxicidad en el medio ambiente, donde en muchas ocasiones, más de las deseadas, acaban por ser vertido debido a motivos de diversa índole, se acumulan en los ecosistemas y en la gran mayoría de casos entran en la cadena alimentaria humana.
Otro ejemplo, que además está a la orden del día, es el de la necesidad de un material que permita sustituir el actual plástico, cuya materia prima proviene de procesos de destilación del petróleo en las instalaciones petroquímicas. Este nuevo material, por si aún lo estás dudando, son los bioplásticos que se pueden obtener a partir de la actividad fermentativa de determinadas especies de bacteria, como por ejemplo los PHA (polihidroxialcanoatos). Estos plásticos presentan propiedades muy interesantes de biodegradabilidad, sin perder las propiedades mecánicas, incluso mejorandolas en algunos casos, que presentan los plásticos tradicionales. Algunas empresas como Neuron BioIndustrial llevan están llevando desde hace años ingentes estudios y proyectos de I+D+i para desarrollar a nivel industrial un proceso de fermentación para la obtención de bioplásticos, registrando ya en el año 2011 la marca TriBioPlast ®.
Del despacho al laboratorio
El primer paso recomendable si se pretende llevar un proceso a escala industrial de algún compuesto de alto valor añadido como los mencionados, es el estudiar la cinética de la reacción que se produce, ya bien sea de tipo químico (con o sin catalizador) o bioquímico (mediante enzimas o microorganismos).
Es necesario planificar adecuadamente los experimentos que se van a llevar a cabo para obtener información válida que nos permita modelizar a partir de las ecuaciones descritas en el módulo Métodos generales de diseño de reactores y cambio de escala.
Existen bases de datos donde se puede consultar si este compuesto ya sido catalogado, sus propiedades físico-químicas, procedencia, cinética, farmacología u otras propiedades que podrían ser de interés para el objetivo del proyecto.
Habitualmente, los compuestos tipo inorgánico tienen estructuras relativamente simples y que se pueden obtener mediante rutas de síntesis químicas de unos pocos pasos.
Por otro lado, la gran mayoría de compuestos presentes en la naturaleza de tipo orgánico, ya bien sea como constituyente de un organismo o como parte de su metabolismo (metabolito), suelen ser moléculas de alta complejidad estructural que requieren de vías de síntesis con un gran número de pasos y requerimientos muy elevados en cuanto a la pureza de los reactivos, lo que encarece el proceso y lo torna menos viable desde un punto de vista económico; con el añadido de los gastos y daños colaterales sobre el medio ambiente.
Un ejemplo de la situación anteriormente descrita, en cuanto a necesidades de mercado a cubrir, sería el de la ingente cantidad de tensioactivos que se prevé será necesario obtener, ya bien sea mediante procesos químicos o bioquímicos, para hacer frente a la demanda creciente en sectores tales como el de la higiene alimentaria,el farmacéutico, el de tratamiento de efluentes residuales, etc. fruto del aumento de la población mundial y del, en ocasiones exponencial ritmo de consumo del mercado, pero que a la vez deberán mostrar propiedades mejores que las actuales, fundamentalmente respecto a su estabilidad medioambiental, siendo los valores actualmente existentes, demasiado elevados para que un aumento en su uso, no provoqué problemas de toxicidad en el medio ambiente, donde en muchas ocasiones, más de las deseadas, acaban por ser vertido debido a motivos de diversa índole, se acumulan en los ecosistemas y en la gran mayoría de casos entran en la cadena alimentaria humana.
Otro ejemplo, que además está a la orden del día, es el de la necesidad de un material que permita sustituir el actual plástico, cuya materia prima proviene de procesos de destilación del petróleo en las instalaciones petroquímicas. Este nuevo material, por si aún lo estás dudando, son los bioplásticos que se pueden obtener a partir de la actividad fermentativa de determinadas especies de bacteria, como por ejemplo los PHA (polihidroxialcanoatos). Estos plásticos presentan propiedades muy interesantes de biodegradabilidad, sin perder las propiedades mecánicas, incluso mejorandolas en algunos casos, que presentan los plásticos tradicionales. Algunas empresas como Neuron BioIndustrial llevan están llevando desde hace años ingentes estudios y proyectos de I+D+i para desarrollar a nivel industrial un proceso de fermentación para la obtención de bioplásticos, registrando ya en el año 2011 la marca TriBioPlast ®.
Del despacho al laboratorio
El primer paso recomendable si se pretende llevar un proceso a escala industrial de algún compuesto de alto valor añadido como los mencionados, es el estudiar la cinética de la reacción que se produce, ya bien sea de tipo químico (con o sin catalizador) o bioquímico (mediante enzimas o microorganismos).
Es necesario planificar adecuadamente los experimentos que se van a llevar a cabo para obtener información válida que nos permita modelizar a partir de las ecuaciones descritas en el módulo Métodos generales de diseño de reactores y cambio de escala.
Podemos extraer la cinética de los resultados obtenidos al llevar a cabo la reacción en condiciones tales que ningún fenómeno de transporte sea controlable sino que sea la propia reacción química la velocidad global observada. Esto resulta útil para obtener información sobre el potencial que presenta la reacción. y se realiza mediante experimentos a pequeña escala de laboratorio o planta piloto en la que el modelo de flujo elegido es el de mezcla perfecta en régimen discontinuo como primera aproximación.
El motivo fundamental es porqué en el modelo de mezcla perfecta, tal y como se explica en el módulo Métodos generales de diseño de reactores y cambio de escala, es un modelo en el que la mezcla de los componentes es perfecta en cualquier instante por lo que la transferencia de materia no sería una etapa limitante. Además esta homogeneïdad y agitación favorecen enormemente la transferencia de energía, no siendo tampoco una etapa limitante de la velocidad del proceso.
En las reacciones catalizadas donde los reactivos han de difundir a través del poro del sólido, es recomendable también tener en cuenta la configuración estructural del material empleado, dado que en las pruebas a escala de laboratorio es probable que se emplee una versión pulverizada del catalizador que finalmente se va a emplear o que durante los experimentos padezcan desgaste mecánico si se utilizan tamaños de partícula mayores y/o saturación de poros por colapso, debido a las fuerzas de cizalla por la agitación de la mezcla de reacción.
Si finalmente el modelo de flujo que se vaya a emplear es el de mezcla perfecta, además de la resistencia química, habrá que tener en cuenta la resistencia mecánica para evitar el desgaste mencionado y la pérdida de finos que causaría, no solo una reducción de superficie activa, entre otros problemas, sino también una posible contaminación del producto.
El motivo fundamental es porqué en el modelo de mezcla perfecta, tal y como se explica en el módulo Métodos generales de diseño de reactores y cambio de escala, es un modelo en el que la mezcla de los componentes es perfecta en cualquier instante por lo que la transferencia de materia no sería una etapa limitante. Además esta homogeneïdad y agitación favorecen enormemente la transferencia de energía, no siendo tampoco una etapa limitante de la velocidad del proceso.
En las reacciones catalizadas donde los reactivos han de difundir a través del poro del sólido, es recomendable también tener en cuenta la configuración estructural del material empleado, dado que en las pruebas a escala de laboratorio es probable que se emplee una versión pulverizada del catalizador que finalmente se va a emplear o que durante los experimentos padezcan desgaste mecánico si se utilizan tamaños de partícula mayores y/o saturación de poros por colapso, debido a las fuerzas de cizalla por la agitación de la mezcla de reacción.
Imagen 1. Transferencias de materia en una reacción catalizada.
Si finalmente el modelo de flujo que se vaya a emplear es el de mezcla perfecta, además de la resistencia química, habrá que tener en cuenta la resistencia mecánica para evitar el desgaste mencionado y la pérdida de finos que causaría, no solo una reducción de superficie activa, entre otros problemas, sino también una posible contaminación del producto.
Complementariamente y a partir del análisis de los resultados se puede determinar si algún producto de la reacción actúa como inhibidor, pues se observará un descenso en la velocidad de reacción y la conveniencia de separarlo durante el proceso. La técnica por excelencia para determinar la presencia y cuantificar compuestos en proceso de obtención de compuestos de alto valor añadido es el HPLC (y cada vez con más frecuencia el IR); sin embargo, si la molécula es un nuevo compuesto no presente en BBDD y se desconoce su estructura, primero habrá que resolverla y posteriormente desarrollar un método específico de detección y cuantificación.
Es sumamente importante monitorizar el proceso y registrar todas aquellas variables de proceso y parámetros de operación que obtenemos del sistema de reacción para poder realizar un análisis de la información y poder determinar puntos óptimos de operación con una determinada configuración y llevar a cabo una primera aproximación a las condiciones que deberemos poner a prueba en el salto de escala.
Del laboratorio a la escala industrial (reactores químicos y bioreactores)
Una vez definida la cinética de la reacción y conocida la influencia del modelo de flujo y de contacto óptimo determinado en el laboratorio llega el momento de dar el salto a una escala mayor.
En el módulo Métodos generales de diseño de reactores y cambio de escala puedes refrescar los conceptos habituales empleados en los procesos de cambio de escala y los métodos empleados habitualmente.
Esta sección se irá ampliando gradualmente a lo largo de la próxima semana.
Gracias por dedicar tu tiempo a la lectura de esta entrada; si detectas cualquier error y deseas informarnos, estaremos encantados de recibir tú comunicación.
Es sumamente importante monitorizar el proceso y registrar todas aquellas variables de proceso y parámetros de operación que obtenemos del sistema de reacción para poder realizar un análisis de la información y poder determinar puntos óptimos de operación con una determinada configuración y llevar a cabo una primera aproximación a las condiciones que deberemos poner a prueba en el salto de escala.
Del laboratorio a la escala industrial (reactores químicos y bioreactores)
Una vez definida la cinética de la reacción y conocida la influencia del modelo de flujo y de contacto óptimo determinado en el laboratorio llega el momento de dar el salto a una escala mayor.
En el módulo Métodos generales de diseño de reactores y cambio de escala puedes refrescar los conceptos habituales empleados en los procesos de cambio de escala y los métodos empleados habitualmente.
Esta sección se irá ampliando gradualmente a lo largo de la próxima semana.
Gracias por dedicar tu tiempo a la lectura de esta entrada; si detectas cualquier error y deseas informarnos, estaremos encantados de recibir tú comunicación.